Bảng hóa trị phía bên trong sách giáo khoa hóa học lớp 8 là phần kỹ năng và kiến thức tương đối cực nhọc với nhiều bạn học sinh. Vị trong bảng có không ít nguyên tố hóa học, cam kết hiệu, phân tử… rất cực nhọc nhớ. Để trực thuộc được bảng hóa trị, không còn cách làm sao khác chúng ta phải cần mẫn học thuộc với ghi nhớ.
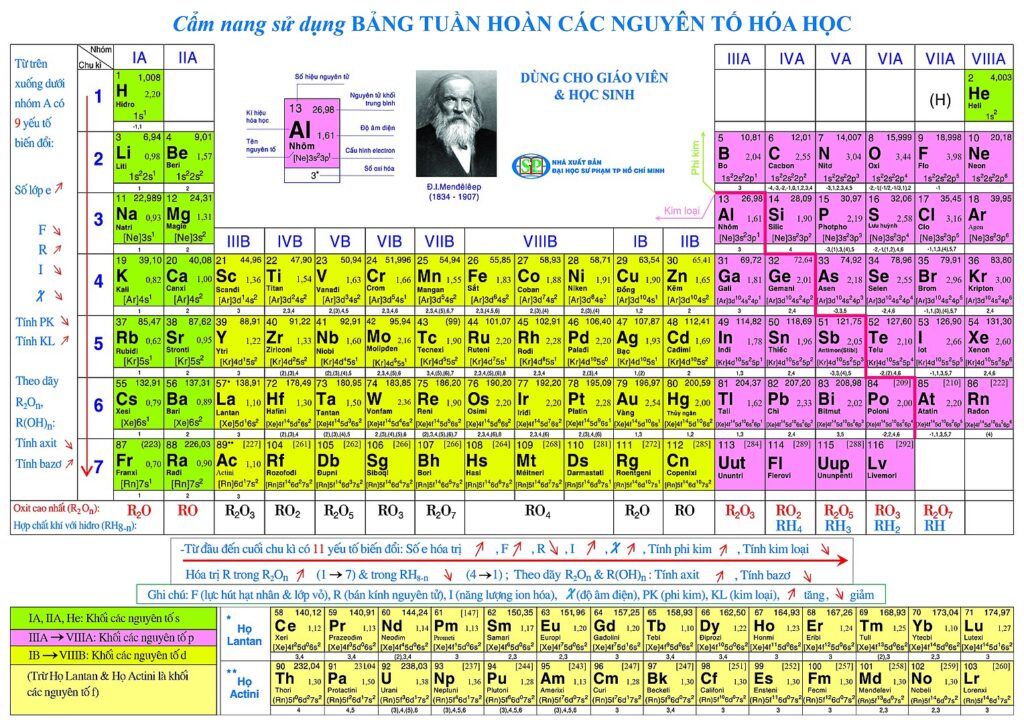
BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
Hóa trị của một nguyên tố chất hóa học được xác minh bằng số link hóa học trong phân tử vì nguyên tử của yếu tắc đó tạo ra. Có những nguyên tố chỉ biểu lộ duy tốt nhất 1 hóa trị nhưng cũng đều có những nguyên tố có không ít hóa trị không giống nhau.
Bạn đang xem: Cách học bảng hóa trị nhanh nhất
Dưới đó là Bảng hóa trị hóa học, bảng này sẽ bao hàm các thông tin:
+ Số Proton
+ thương hiệu nguyên tố
+ Nguyên tử khối
+ ký hiệu hóa học
+ Hóa trị của nhân tố (trình bày theo vần âm La Mã được biểu đạt ở cột cuối cùng).
CÁCH HỌC THUỘC BẢNG HÓA TRỊ CỦA CÁC NGUYÊN TỐ
Có nhiều cách thức học ở trong bảng hóa trị, nhưng lại 2 phương pháp học sau được nhiều giáo viên và học sinh áp dụng nhất:
1. Học thuộc những bài ca hóa trị
Có nhiều bài xích ca hóa trị không giống nhau được sáng sủa tác nhằm mục đích giúp các bạn học sinh học thuộc hóa trị của các nguyên tố một cách mau lẹ và thú vị. Thế thể:
– bài ca hóa trị tiên phong hàng đầu (bao gồm những chất thịnh hành thường gặp mặt nhất)
Kali, Iot, Hidro
Natri với Bạc, Clo một loài
Có hóa trị I chúng ta ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bari
Cuối cùng thêm chú Oxi
Hóa trị II ấy bao gồm gì khó khăn khăn
Bác Nhôm hóa trị III lần
Ghi sâu đầu óc khi cần phải có ngay
Cacbon, Silic này đây
Là hóa trị IV ko ngày nào quên
Sắt kia đề cập cũng thân quen tên
II, III tăng lên và giảm xuống thật phiền lắm thay
Nitơ băn khoăn nhất đời
I, II, III, IV khi cho nên V
Lưu huỳnh lắm lúc chơi khăm
Lúc II, dịp VI lúc nằm sản phẩm công nghệ IV
Photpho nói tới không dư
Nếu ai hỏi mang lại thì ừ rằng V
Bạn ơi cố gắng học chăm
Bài ca hóa trị xuyên suốt năm khôn cùng cần
– bài xích ca hóa trị số 2 cụ thể (gồm nhiều hóa trị hơn)
Hidro (H) cùng với Liti (Li)
Natri (Na) cùng rất Kali (K) chẳng rời
Ngoài ra còn bội nghĩa (Ag) sáng sủa ngời
Chỉ với hóa trị I thôi chớ nhầm
Riêng Đồng (Cu) cùng rất Thuỷ ngân (Hg)
Thường II ít I chớ đắn đo gì
Đổi cố kỉnh II, IV là Chì (Pb)
Điển hình hoá trị của Chì (Pb) là II
Bao giờ thuộc hoá trị II
Là Oxi (O), Kẽm(Zn) chẳng không nên chút gì
Ngoài ra còn có Canxi (Ca)
Magie (Mg) cùng với Bari (Ba) một nhà
Bo (B), Nhôm (Al) thì hóa trị III
Cacbon (C), Silic (Si), Thiếc (Sn) là IV thôi
Thế nhưng yêu cầu nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II suy tính bộn bề
Không bền bắt buộc dễ phát triển thành liền fe III
Photpho (P) III ít gặp gỡ mà
Photpho (P) V chính bạn ta gặp gỡ nhiều
Nitơ (N) hoá trị từng nào ?
I, II, III, IV hầu như tới V
Lưu huỳnh (S) lắm lúc tập luyện khăm
Khi II thời điểm IV, VI tăng tột cùng
Clo Iot lung tung
II III V VII thường xuyên thì I thôi
Mangan (Mn) rắc rối nhất đời
Đổi trường đoản cú I đến VII thời new yên
Hoá trị II cũng dùng nhiều
Hoá trị VII cũng rất được yêu giỏi cần
Bài ca hoá trị thuộc lòng
Viết thông phương pháp đề phòng lãng quên
Học hành nỗ lực cần chuyên
Siêng ôn siêng luyện tất nhiên nhớ nhiều.
2. Làm bài tập liên tiếp để ghi nhớ hóa trị, bắt đầu từ yếu tố nhỏ
Chúng ta cần nắm rõ kiến thức về hóa trị và tính luật lệ hóa trị dưới đây:
– call hóa trị của H là I ⇒ rước làm đối kháng vị, hóa trị của các nguyên tố hay những nhóm nguyên tử được khẳng định bằng số nguyên tử H nhưng nguyên tố (hay team nguyên tử) có thể liên kết cùng với nhau.
– Axa
Byb với:
Theo luật lệ hóa trị: x ×a=y×b ta có ví dụ:
Từ CTHH của hợp chất Fe III(OH)3I, ta có cách tính như sau: 1 x III = 3 x I
– Các chúng ta có thể vẽ bảng tuần hoàn hóa học theo sơ đồ tứ duy cùng dán vào góc học tập tập, bìa sách, bàn học tập để hoàn toàn có thể quan sát hàng ngày. Câu hỏi tự vẽ theo sơ thứ cũng là 1 cách để chúng ta học trực thuộc những kiến thức khô khan này.
Nắm chắc chắn được bảng hóa trị của không ít nguyên tố chất hóa học quan trọng, các các bạn sẽ dễ dàng làm được những bài xích tập dạng cân đối phương trình hóa học, tính số mol, tính hóa trị và rất nhiều dạng bài bác tập khác. Chúc chúng ta học hiệu quả!
Cách học tập thuộc bảng hóa trị lớp 8. Được Vn
Doc biên soạn tổng thích hợp là những cách khiến cho bạn đọc có thể gh nhớ bảng tuần trả một phương pháp nhanh chóng, dễ thuộc. Đây là tài liệu tìm hiểu thêm hay được cửa hàng chúng tôi sưu tầm nhằm gửi tới chúng ta học sinh nhằm mục đích giúp các bạn học hóa trị Hóa lớp 8 dễ dãi học nằm trong bảng hóa trị những nguyên tố hóa học.
Cách học tập thuộc hoá trị 8 thuận tiện nhất
I. Hóa trịII. Biện pháp học thuộc hóa trị lớp 8 dễ dàng dàng
III. Bài tập vận dụng luyện tập giải pháp học ở trong hóa trị lớp 8
Hóa trị là của một yếu tắc được xác định bằng số link hóa học nhưng một nguyên tử của yếu tắc đó tạo cho trong phân tử. Vậy cách xác minh hóa trị như vậy nào? và nó có ý nghĩa sâu sắc như nỗ lực nào? nội dung bài viết dưới đây giúp cho bạn đọc nắm rõ hơn về hóa trị.
I. Hóa trị
1. Hoá trị một thành phần được khẳng định như cầm cố nào?
* phương pháp xác định:
+ Quy ước: Gán cho H hoá trị I, lựa chọn làm đối kháng vị.
+ Một nguyên tử của nhân tố khác liên kết với từng nào nguyên tử Hiđro thì nói nguyên tố đó bao gồm hoá trị bởi bấy nhiêu.
Ví dụ: HCl: Cl hoá trị I.
H2O: O............II
NH3: N ...........III
CH4: C ............IV
+ phụ thuộc khả năng liên kết của các nguyên tố không giống với O. (Hoá trị của oxi bằng 2 1-1 vị, Oxi tất cả hoá trị II).
Ví dụ: K2O: K bao gồm hoá trị I.
Ba
O: cha ..............II.
SO2: S ..................IV.
- Hoá trị của nhóm nguyên tử:
Ví dụ: HNO3: NO3 gồm hoá trị I.
Vì :Liên kết với cùng 1 nguyên tử H.
H2SO4: SO4 bao gồm hoá trị II.
HOH: OH .................I
H3PO4: PO4................III.
* Kết luận: Hoá trị là nhỏ số thể hiện khả năng link của nguyên tử thành phần này với nguyên tử thành phần khác.
2. Luật lệ hoá trị
2.1. Quy tắc:
*CTTQ: Ax
By => ax = by
x,y,a,b là số nguyên
*Quy tắc: vào CTHH, tích của chỉ số cùng hóa trị của thành phần này bởi tích của chỉ số cùng hóa trị của nguyên tố kia
Quy tắc này đúng cho tất cả B là đội nguyên tử.
2.2.Vận dụng:
a.Tính hoá trị của một nguyên tố:
Zn
Cl2: 1.a= 2.I => a= II
Al
Cl3: 1.a= 3.I => a = III
Cu
Cl2: 1.a = 2.I => a= II
b.Tính hoá trị của một nguyên tố:
* Ví dụ: Tính hoá trị của Al trong các hợp chất sau: Al
Cl3 (Cl có hoá trị I).
- call hoá trị của nhôm là a: 1.a = 3.I
Fe
Cl : a = II
Mg
Cl 2: a = II
Ca
CO3 : a = II (CO3 = II).
Na2SO3 : a = I
P2O5 :2.a = 5.II a = V.
* Nhận xét:
a.x = b.y = Bội số chung nhỏ dại nhất.
c.Lập phương pháp hoá học tập của hợp chất theo hoá trị:
* lấy một ví dụ 1: phương pháp tổng quát: Sx
Oy
Theo quy tắc: x . VI = y. II = 6.
Vậy: x = 1; y = 3.
Công thức hóa học: SO3
* lấy một ví dụ 2: Na(SO4)y
Công thức hóa học: Na2SO4.
BẢNG HÓA TRỊ
| Số hiệu nguyên tử (Z) | Tên cũ | Tên nguyên tố hóa học (IUPAC) | Kí hiệu hoá học | Khối lượng yếu tố (amu) | Hoá trị |
| 1 | Hiđro | Hydrogen | H | 1 | I |
| 2 | Heli | Helium | He | 4 | |
| 3 | Liti | Lithium | Li | 7 | I |
| 4 | Beri | Beryllium | Be | 9 | II |
| 5 | Bo | Boron | Bo | 11 | III |
| 6 | Cacbon | Carbon | C | 12 | IV, II |
| 7 | Nitơ | Nitrogen | N | 14 | II, III, IV… |
| 8 | Oxi | Oxygen | O | 16 | II |
| 9 | Flo | Flourine | F | 19 | I |
| 10 | Neon | Neon | Ne | 20 | |
| 11 | Natri | Sodium | Na | 23 | I |
| 12 | Magie | Magnesium | Mg | 24 | II |
| 13 | Nhôm | Aluminium | Al | 27 | III |
| 14 | Silic | Silicon | say mê | 28 | IV |
| 15 | Photpho | Phosphorus | p. | 31 | III, V |
| 16 | sulfur | Sulfur | S | 32 | II, IV, VI |
| 17 | Clo | Chlorine | Cl | 35,5 | I,… |
| 18 | Agon | Argon | Ar | 39,9 | |
| 19 | Kali | Potassium | K | 39 | I |
| 20 | Canxi | Calcium | Ca | 40 | II |
II. Bài ca hóa trị mới
BÀI CA HÓA TRỊ
Kali (K-Potassium), Iot (I- Iodine), Hidrô (H- Hydrogen)Natri (Na- Sodium) với bội bạc (Ag- Silver), Clo (Cl- Chlorine), Flo (F- Fluorine) một loài
Là hoá trị I hỡi ai
Nhớ ghi mang đến rõ khỏi hoài phân vân
Magiê (Mg- Magnesium), Chì (Pb- Lead), Kẽm (Zn- Zinc) ,Thuỷ Ngân (Hg- Mercury)Oxi (O- Oxygen), Đồng (Cu- Copper), Thiếc (Sn- Tin) góp phần Bari (Ba- Barium)
Cuối thuộc thêm chú canxi (Ca- Calcium)Hoá trị II nhớ bao gồm gì nặng nề khăn
Bác Nhôm (Al- Aluminium) hoá trị III lần
In sâu đầu óc khi cần phải có ngay
Cacbon (C- Carbon), Silic (Si- Silicon) này đây
Có hoá trị IV không ngày làm sao quên
Sắt (Fe- Iron) kia kể cũng quen tên
II, III lên xuống nhớ tức tốc ngay thôi
Nitơ (N- Nitrogen) vấn đề nhất đời
I, II, III, IV chờ thời lên VLưu huỳnh (S- Sulfur) lắm khi thi đấu khăm
Xuống II lên VI lúc nằm thứ IVPhot pho (P- Phosphorus) kể tới không dư
Có ai hỏi cho ừ rằng III, VEm ơi, cố gắng học chăm
Bài ca hoá trị trong cả năm vô cùng cần./Hóa trị một số nhóm:
I: OH, NO3, NH4…; II: SO4, CO3, SO3, Si
O3…; III: PO4…
III. Biện pháp học trực thuộc hóa trị lớp 8 dễ dàng dàng
Hóa trị là của một yếu tố được khẳng định bằng số liên kết hóa học tập một nguyên tử của yếu tắc đó làm cho trong phân tử. Hóa trị của nguyên tố trong hợp chất ion là điện hóa trị, có giá trị bằng điện tích của ion tạo thành tử yếu tắc đó.
1. Cách học trực thuộc hóa trị lớp 8
Hóa trị I: Hg, Ag, Na, Cl, K, Li. Đọc là: Hết bạc tình Na Lo tìm Liền
Hóa trị II: Mg, Ca, Ba, Pb. Cu, Hg, Fe, Zn – đọc là: Má Cản bố Phá shop Sắt Kẽm
Hóa trị III: có Al với Fe
Hóa trị I là: Na, K, Ag, Cl.
Hóa trị III là: Al, Fe
Hóa trị II: còn sót lại (với fe có hóa trị II và III luôn).
Hoặc là học câu nói vui sau: nhì Bà Cả không mua Chì Kẽm fe Cũng Mãi một năm Ăn hết khoảng chừng ba Phen Vàng mà lại Sắt Nhôm năm Phen tứ Chỉ
Cách học thuộc hóa trị của nguyên tố dễ ợt thì học viên nên lấy phần đa hợp chất của oxi để làm ví dụ tiếp đến xác định hóa trị của các nguyên tố khác.
Ví dụ: BOy hóa trị của B bằng 2y. B2Oy hóa trị của B bởi y (Trừ B là hidro)
SO3 hóa trị S bằng VI
K2O hóa trị K bởi II
Al2O3 hóa trị Al bởi III
Ba
O hóa trị ba bằng II
Cu
O hóa trị Cu bằng II
Fe2O3 hóa trị Fe bởi III
Fe
O hóa trị Fe bằng II
2. Giải pháp học ở trong hóa trị lớp 8 theo số hóa trị của nguyên tố
Chúng ta nên hãy nhờ rằng hóa trị đề xuất ghi bằng chữ số La Mã. Tựa như như vậy so với các hợp chất khác.
Hóa trị thì học tập theo nhóm đến dễ:
Nhóm có một hóa trị:
Bao có nhóm hóa trị I, II, III, IV
Hóa trị I gồm những: H, Li, F, Na, Cl, K, Ag, Br
Hóa trị II gồm những: Be, O, Mg, Ca, Zn, Ba, Hg
Hóa trị III gồm những: B, Al
Hóa trị IV gồm những: Si
Nhóm có khá nhiều hóa trị bao gồm:
Cacbon: IV, II
Chì: II, IV
Crom: III, II
Nito: III, II, IV
Photpho: III, V
Lưu huỳnh: IV, II, VI
Mangan: IV, II, VII…….Các hóa trị in đậm thường sử dụng nhiều nhất trong khi học.
Có 5 nhóm nên thuộc hóa trị bảng trang 42 SGK chất hóa học 8 những em yêu cầu học thuộc
Hóa trị của các gốc bao gồm nhiều nguyên tố hóa học:
Các nơi bắt đầu hóa trị I gồm: OH (hidroxit ), NO3 (nitrat)
Các nơi bắt đầu hóa trị II gồm: CO3 ( cacbonat ), SO4 (sunfat)
Các gốc hóa trị III gồm: PO4 (photphat)
3. Bài bác ca hóa trị
Ngoài ra còn có bài thơ hóa trị mang lại nhanh-gọn-nhẹ:
Kali (K), iốt (I) Hidrô (H)
Natri với tệ bạc (Ag), clo (Cl) một loài
Là hoá trị (I) hỡi ai,
Nhớ ghi cho kỹ ngoài hoài phân vân.
Magiê (Mg) , kẽm với thuỷ ngân (Hg),
Ôxi (O), đồng(Cu), thiếc (Sn) góp thêm phần bari
Cuối cùng thêm chú canxi,
Hoá trị II nhớ gồm gì cực nhọc khăn.
Này nhôm hoá trị III lần
In sâu trí nhớ khi cần phải có luôn.
Cacbon, silic(Si) này đây,
Có hoá trị IV không ngày làm sao quên.
Sắt kia lắm lúc hay phiền,
II, III nhớ liền nhau thôi.
Lại gặp mặt nitơ khổ rồi
I, II, III, IV lúc thời lên V
Lưu huỳnh lắm khi tập luyện khăm
Xuống II lên VI khi nằm sản phẩm IV
Phốt pho kể đến không dư
Có ai hỏi mang lại thì ừ rằng V
Em ơi gắng học chăm
Bài ca hoá trị cả năm buộc phải dùng.
4. Bài xích ca Hóa trị yếu tắc theo danh pháp QUỐC TẾ
Chlo-rine (Cl), Po-tas-si-um (K)
Hy-dro-gen (H), So-di-um (Na), Sil 0 vẻ (Ag)
Và I-o (d) -dine nữa cơ
Đều cùng hóa trị một (I) nha mọi người
Mag-ne(s)-si-um (Mg), cop-per (Cu)
Ba-ri-um (Ba), Zinc (Zn), Lead (Pb), Mer-cu-ry (Hg)
Cal-ci-um (Ca), O-xy-gen (O)
Hóa trị nhì (II) ấy bao gồm phần dễ hơn
Bác a-lu-mi-ni-um (Al)
Hóa trị là (III) ghi trọng tâm khắc cốt
Car-bon (C) cùng Si-li-con (Si)
Là hóa trị bốn (IV) khi yêu cầu chớ quên
Ni-tro-gen (N) trắc trở hơn
Một hai ba bốn (I, II, III, IV) khi thì năm (V)
Sul -fur (S) lắm khi tập luyện khăm
Lúc nhị (II), dịp sáu (VI) lúc nằm thứ tư (IV)
Phos-pho-rus (P) đề cập không dư
Nếu ai hỏi hỏi mang đến ừ thì là năm (V)
Bạn ơi nỗ lực học chăm
Bài ca hóa trị xuyên suốt năm siêu cần
IV. Bài xích tập áp dụng luyện tập phương pháp học ở trong hóa trị lớp 8
1. Giải pháp làm dạng bài xích tập hóa trị
Bài tập tìm công thức hóa học tập của hợp chất biết hóa trị
Bước 1: Viết bí quyết hóa học chung
B ước 2: Theo nguyên tắc hóa trị:
a.x = b.y
=>Tìm giá trị của chỉ số
Chọn x = b’; y = a’, suy ra công thức hóa học tập đúng.
Chú ý: Nếu một đội nguyên tử thì nên xem như một nguyên tố với lập phương pháp hóa học tập như một yếu tắc khác.
Khi viết hóa trị nên viết theo số La Mã, còn chỉ số là số tự nhiên.
Yêu cầu: Để lập được cách làm hóa học của đúng theo chất buộc phải nắm kiên cố kí hiệu hóa học với hóa trị của các nguyên tố khiến cho hợp chất đó.
* Hoặc ghi nhớ mẹo hóa trị một vài nguyên tố thường chạm chán như sau:
Hóa trị I là: K na Ag H Br Cl
Khi cô gái Ăn Hắn bỏ Chạy
Hóa trị II là: O bố Ca Mg Zn fe Cu
Ông ba Cần May Zap fe Đồng
Hóa trị III là: Al Fe
Anh Fap
Đối cùng với nguyên tố có nhiều hóa trị thì đề sẽ mang lại hóa trị ta chỉ tuân theo thôi.
Ví dụ 1: Lập cách làm hóa học tập của đúng theo chất:
a) Nhôm oxit được khiến cho tử 2 nguyên tố oxi và nhôm Al
Hướng dẫn giải chi tiết bài tập
Theo luật lệ hóa trị ta có:
x . III = y . II
=> x = 2; y = 3
Vậy phương pháp hóa học: Al2O3
b) Cacbon đioxit tất cả C(IV) với O (II)
Hướng dẫn giải chi tiết bài tập
Theo phép tắc hóa trị ta có:
x . IV = y . II
=> x = 1; y = 2
Vậy công thức hóa học: CO2
b) Natri photphat gồm Na (I) với PO4(III)
Hướng dẫn giải chi tiết bài tập
Theo quy tắc hóa trị ta có:
x . I = y . III
=> x = 3; y = 1
Vậy phương pháp hóa học: Na3PO4
Viết phương pháp hóa học hoặc lập nhanh phương pháp hóa học: ko cần làm theo từng bước ví dụ như trên, mà chỉ việc nắm rõ nguyên tắc chéo: Hóa trị của yếu tắc này sẽ là chỉ số của nguyên tố kia và ngược lại (với đk rằng những tỉ số phải tối giản trước).
Chú ý: ví như hai nguyên tố thuộc hóa trị thì không yêu cầu ghi chỉ số (mặc định là 1 trong rồi)
Ví dụ 1: Viết bí quyết hóa học tập của hợp hóa học tạo bởi vì S (VI) và O.
Hướng dẫn giải chi tiết bài tập
=> bí quyết hóa học SO3
(Do VI / II = 3/1 nên chéo cánh xuống chỉ số của S là 1 trong còn O là 3).
Ví dụ 2: Viết phương pháp hóa học tập của Fe(III) với SO4 hóa trị (II)
Hướng dẫn giải chi tiết bài tập
Công thức chất hóa học Fe2(SO4)3
(Lí giải: tỉ lệ thành phần hóa trị III cùng II không nên tối giản, hóa trị III của Fe đổi mới chỉ số 3 của SO4, như vậy đề xuất đóng ngoặc đội SO4, gọi là tất cả 3 team SO4. Hóa trị II của SO4 trở thành chỉ số 2 của Fe.)
Chú ý: Khi sẽ thành thạo, nắm rõ quy tác bạn có thể không yêu cầu viết hóa trị lên trên đỉnh nguyên tố, đội nguyên tử.
2. Bài xích tập áp dụng luyện tập biện pháp học trực thuộc hóa trị lớp 8
Câu 1. Lập công thức hóa học của những hợp chất với hidro của các nguyên tố dưới đây:
a) N (III)
b) C (IV)
c) S (II)
d) Cl
Chú ý: a, b viết H lép vế nguyên tố N, C.
c, d viết H đứng trước nguyên tố S cùng Cl.
Câu 2. Lập công thức hóa học cho những hợp chất:
a. Cu(II) với Cl
b. Al và NO3
c. Ca cùng PO4
d. NH4 (I) với SO4
e. Mg với O
g. Fe(III) cùng SO4
Câu 3. Lập phương pháp hóa học của những hợp chất:
| 1. Al với PO4 | 2. Na với SO4 | 3. Sắt (II) và Cl | 4. Mg cùng CO3 |
| 5. Hg (II) cùng NO3 | 6. Zn và Br | 7. K với SO3 | 8. Na và Cl |
| 9. Na với PO4 | 10. Tía và HCO3(I) | 11. K và H2PO4(I) | 12. Na cùng HSO4(I) |
Câu 4. Lập bí quyết hóa học thích hợp chất.
1) Lập CTHH hợp hóa học tạo bởi vì nhóm NO3 với nguyên tố Al. Mang lại biết ý nghĩa CTHH trên.
2) Lập CTHH hợp hóa học phân tử gồm: bố và SO4. Mang đến biết ý nghĩa sâu sắc CTHH trên.
Xem thêm: Cách làm sạch ốp lưng silicon màu nhanh, đúng cách, tại sao ốp trong suốt bị vàng
3) Lập CTHH phù hợp chất bao gồm phân tử có nguyên tố Mg với nhóm OH. Mang đến biết ý nghĩa CTHH trên.
Câu 5. Viết CTHH của những hợp hóa học với lưu hoàng (II) của các nguyên tố sau đây:
a) K (I)
b) fe (II)
c) Al (III)
d) Hg (II)
Câu 6. Viết CTHH với tính phân tử khối của các hợp hóa học sau:
a) Điphotpho pentaoxit có P(V) với O.
b) Axit sunfuric tất cả H và SO4.
c) Bari cacbonat gồm cha và CO3.
d) canxi photphat bao gồm Ca với PO4.
Câu 7. Viết bí quyết hóa học (CTHH) của những muối nhưng mà phân tử gồm có:
a) sắt (II) liên kết với (NO3) (nitrat)
b) Na links với SO4 (sunfat)
c) Cu (II) liên kết với Cl (clorua)
d) Ca liên kết với PO4 (photphat)
Câu 8. (*) Xét các CTHH: Z(NO3)3; (NH4)3T; X2SO4; H2Y. Biết hóa trị của SO4 là (II), NH4 (I), NO3(I). Viết CTHH của hợp hóa học gồm:
| a) X và H | b) Z với SO4 | c) T và H | d) X với Y |
| e) X với T | f) Y cùng Z | g) Z và T. |
Câu 9. (*) Cho 2 chất có CTHH là A2S và B2O3. CTHH của hợp chất tạo bởi vì A và B là?
3. Lí giải giải bài tập chất hóa học lớp 8 bài xích hóa trị
Câu 1.
| a) NH3 | b) CH4 | c) H2S | d) HCl |
Câu 2.
| a) Cu Cl2 | b) Al(NO3)3 | c) Ca3(PO4)2 |
| d) (NH4)2SO4 | e) Mg O | f) Fe2(SO4)3 |
Câu 3.
| 1.Al PO4 | 2. Na2SO4 | 3. Fe Cl2 | 4. K2SO3 |
| 5. Na Cl | 6. Na3PO4 | 7. Mg CO3 | 8. Hg(NO3)2 |
| 9. Zn Br2 | 10. Ba(HCO3)2 | 11. KH2PO4 | 12. Na HSO4 |
Câu 4.
1) Al(NO3)3
– Tạo vì 3 nguyên tố Al, N, O.
– gồm 1Al, 3N, 9O.
– PTK = 27 + 3 . 14 + 9 . 16 = 213.
3) Mg(OH)2
– Tạo bởi 3 nguyên tố Mg, O, H.
– tất cả 1Mg, 2O, 2H.|
– PTK = 24 + 2 . 16 + 2 . 1 = 58.
2) Ba
SO4
– Tạo bởi 3 yếu tố Ba, S cùng O.
– gồm một Ba, 1S, 4O.
– PTK = 137 + 32 + 4 . 16 = 233.
Câu 5.
| a) K2S | b) Hg S | c) Al2S3 | d) Fe S. |
Câu 6.
a) P2O5 = 142.
b) Ca3(PO4)2 = 310.
c) H2SO4 = 98.
d) Ba
CO3 = 197.
Câu 7.
| a) Fe(NO3)2 | b) Cu Cl2 | c) Na2SO4 | d) Ca3(PO4)2 |
Câu 8. (*)
a) XH3
b) Z2(SO4)3
c) TH3 d) XY
e) X3T2
f) Y3Z2 g) XT
Câu 9. (*)
Đáp số: A3B
4. Câu hỏi trắc nghiệm hóa trị liên quan
Câu 1: Hợp hóa học Alx(NO3)3 có phân tử khối 213. Quý giá của x là:
A. 3
B. 2
C. 1
D. 4
Câu 2: Biết hidroxit gồm hóa trị I, bí quyết hòa học nào đó là sai
A. Na
OH
B. Cu
OH
C. KOH
D. Fe(OH)3
Câu 3: Bari bao gồm hóa tri II. Chọn cách làm sai
A. Ba
SO4
B. Ba
O
C. Ba
Cl
D. Ba(OH)2
Câu 4: Nguyên tử Fe bao gồm hóa trị II trong phương pháp nào
A. Fe
O
B. Fe2O3
C. Fe
D. Fe
Cl3
Câu 5: Khi so sánh hợp chất (X) cất 27,273% cacbon và còn lại là oxi. Hóa trị của cacbon vào hợp hóa học trên là bao nhiêu?
A. I
B. II
C. III
D. IV
Câu 6: cho hợp hóa học (A) có dạng Alx(SO4)y cùng phân tử khối bởi 342 đv
C. Biết nhôm tất cả hóa trị III. Hóa trị của group SO4 là:
A. I
B. II
C. III
D. IV
Câu 7: Lập bí quyết hóa học biết hóa trị của X là I và số phường = e là 13 và Y có nguyên tử khối là 35.5
A. Na
Cl
B. Ba
Cl2
C. Na
O
D. Mg
Cl
Câu 8: tuyên bố nào tiếp sau đây không đúng?
A. Trong số hợp chất hiđrô thông thường sẽ có hóa trị I và oxi thường sẽ có hóa trị II
B. Mỗi nguyên tố chỉ có một hóa trị
C. Từng nguyên tố gồm thể có rất nhiều hóa trị
D. Hóa trị của yếu tố là con số biểu hiện khả năng links của nguyên tử kia với nguyên tử của nguyên tố khác
Câu 9: Một hợp hóa học (Q) có thành phần khối lượng là: 34,5% Fe và 65,5% Cl. Hóa trị của fe trong hợp hóa học (Q) là:
A. I
B. II
C. III
D. IV
Câu 10: Lập phương pháp hóa học tập của Ca (II) với OH (I)
A. Ca
OH
B. Ca(OH)2
C. Ca2(OH)
D. Ca3OH
Câu 11. Cho hợp chất (X) bao gồm dạng Bax(PO4)y với phân tử khối bằng 601 đv
C. Biết tía có hóa trị II. Hóa trị của nhóm SO4 là:
A. I
B. II
C. III
D. IV
Câu 12. Cho biết phương pháp hóa học tập của yếu tố X cùng với oxi là: A2O3, bí quyết hóa học của yếu tố B cùng với hiđro là: BH2. Vậy hợp hóa học của A cùng B có công thức hóa học là:
A. A2B3.
B. A2B.
C. AB3.
D. AB.
Câu 13. Lập phương pháp hóa học tập của Ba(II) với OH(I)
A. Ba
OH
B. Ba(OH)2
C. Ba2(OH)
D. Ba3(OH)2
Câu 14. Cho cách làm hoá học của fe (III) oxit là Fe2O3, axit sunfuric là H2SO4
Công thức chất hóa học đúng của sắt (III) sunfat là:
A. Fe
SO4.
B. Fe3SO4.
C. Fe3(SO4)2.
D. Fe2(SO4)3.
Câu 15. Cho hóa trị của N là V, chọn phương pháp hóa học đúng trong các công thức hóa học sau:
A. NO2.
B. N2O3.
C. N2O.
D. N2O5.
Câu 16. Cho biết phương pháp hóa học của yếu tố X với oxi là: X2O3, công thức hóa học tập của yếu tắc Y với hiđrô là: YH2. Vậy hợp chất của X và Y gồm công thức hóa học là:
A. X2Y3.
B. X2Y.
C. XY3.
D. XY.
Câu 17. Hóa tri của yếu tắc N lần lượt có các hợp hóa học NO, NO2 ,N2O, N2O5
A. II, IV, I, V
B. II, V, I, IV
C. I, IV, II, V
D. II, III, I, V
Câu 18. Ta gồm một oxit thương hiệu Cr2O3. Vậy muối bột của Crom bao gồm hóa trị tương ứng là
A. Cr
SO4
B. Cr(OH)3
C. Cr2O3
D. Cr2(OH)3
5. Đáp án lý giải giải bỏ ra tiết câu hỏi trắc nghiệm
| 1. C | 2. B | 3. C | 4. A | 5. D | 6. B |
| 7. A | 8. B | 9. C | 10. B | 11. C | 12. A |
| 13. B | 14. D | 15. D | 16. A | 17. A | 18. B |
Đáp án giải đáp giải cụ thể
Câu 5.
Gọi cách làm tổng quát: COx ( x ∈ N* )
Ta có: %C = (12.100)/(12+16x) = 27,273 (1)
Giải phương trình (1) ta có: x = 2
⇒ CTHH: CO2
Áp dụng phép tắc hóa trị ta có
a.1 = II.2
⇒ a = (II.2)/1 = IV
Vậy hóa trị của C là IV
Câu 7.
Vì Y tất cả nguyên tử khối là 35. 5 → Cl. X bao gồm số p= e là 13
→ Natri mà có hóa trị I → Na
Cl
Câu 9.
Đặt phương pháp hóa học tập của hợp hóa học là Fe
Clx (x: hóa trị của Fe, x ∈ N*)
=> M(hợp chất) = m
Fe : %m
Fe= 56 : 34,46% ≈ 162,5 (g/mol)
=> x= (162,5 - 56)/ 35,5 = 3
=> CTHH là Fe
Cl3 với hóa trị của fe trong hợp chất là III.
Câu 12.
Gọi hóa trị của yếu tắc X là a
Ta có:

Theo quy tắc hóa trị: a . 2 = II . 3 => a = III
Gọi hóa trị của thành phần B là b
Ta có:

Theo luật lệ hóa trị: b . 1 = I . 2 => b = II
Gọi công thức hợp hóa học của X cùng Y là: Ax
By
Ta có:

Theo quy tắc hóa trị: III . X = II . Y => x/y = 2/3
=> chọn x = 2 với y = 3
=> bí quyết hợp chất đề nghị tìm là A2B3
Trên đấy là hướng dẫn chi tiết cách học tập thuộc hóa trị lớp 8 và bài xích tập, lời giải chi tiết, muốn rằng bổ ích đối với những em trong việc học hóa học giỏi hơn.
....................................
Mời những bạn đọc thêm một số tài liệu liên quan:
Vn
Doc vẫn gửi tới chúng ta Hóa học lớp 8: bí quyết thuộc hóa trị dễ ợt nhất giúp cho bạn học trực thuộc hóa trị một biện pháp nhanh nhất. Thông qua các quy tắc hóa trị, bảng hóa trị những nguyên tố cũng như đưa những bài hát. Hy vọng tài liệu này góp ích các bạn dễ dàng ghi lưu giữ hóa trị những nguyên tố một phương pháp dễ dàng tương tự như củng cố, ôn tập lý thuyết, dạng bài bác tập, liên quan một biện pháp thành thành thạo nhất
Trên đây Vn
Doc đã trình làng tới chúng ta Hóa học tập lớp 8: bí quyết thuộc hóa trị dễ dàng nhất. Để có kết quả cao rộng trong học tập tập, Vn
Doc xin reviews tới các bạn học sinh tài liệu chăm đề Toán 8, lý thuyết Vật Lí 8, lý thuyết Sinh học tập 8, Giải bài bác tập chất hóa học 8, Tài liệu tiếp thu kiến thức lớp 8 mà lại Vn
Doc tổng hợp với đăng tải.









