Axit sunfuric (H2SO4) là 1 hợp hóa chất vô cùng quen thuộc trong đời sống. Tuy nhiên, cách pha loãng axit sunfuric đặc thì ko phải ai cũng biết. Nội dung bài viết dưới đây đang cung cấp cho chính mình một số thông tin cần thiết về cách áp dụng hợp chất này làm thế nào cho hiệu quả.
Tính chất của axit sunfuric
Tính hóa học vật lý
- H2SO4 là chất lỏng, dạng nhớt, nặng hơn nước, khó bay hơi và bao gồm độ tan vô hạn trong nước.
Bạn đang xem: Cách pha loãng axit sunfuric đặc
- H2SO4 đặc có tính háo nước, hút nước to gan và tỏa những nhiệt.
- Axit sunfuric có chức năng làm than hóa những hợp chất hữu cơ.
Tính hóa học hóa học
1. Axit sunfuric loãng
- Axit sunfuric loãng là 1 trong những axit dạn dĩ với đầy đủ các đặc điểm hóa học chung của một axit, bao gồm:
+ chuyển màu giấy quỳ tím thành màu sắc đỏ.
+ tính năng với kim loại đứng trước hydro vào dãy hoạt động hóa học của kim loại.
K > ba > Ca > na > Mg > Al > Zn > Fe2+ > Ni > Sn > Pb > H > Cu > Hg+ > Ag > Pt >Au
Ví dụ:
Fe + H2SO4 → Fe
SO4 + H2
+ công dụng với bazơ tạo ra muối với nước
H2SO4 + Na
OH → Na
HSO4 + H2O
H2SO4 + 2Na
OH → Na2SO4 + 2H2O
+ Axit sunfuric loãng chức năng với oxit bazơ tạo ra muối với nước
H2SO4 + Mg
O → Mg
SO4 + H2O
H2SO4 + Cu
O → Cu
SO4 + H2O
+ công dụng với muối tạo thành muối hạt mới, axit mới và sắt kẽm kim loại trong muối không thay đổi hóa trị.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + Ba
Cl2 → Ba
SO4 +2HCl
2. Axit sunfuric đặc
Trong axit sunfuric đặc thì S có mức lão hóa +6 cao nhất, cho nên vì thế H2SO4 đặc gồm tính axit mạnh, tính oxy hóa mạnh khỏe và bao gồm tính háo nước.
+ chức năng với kim loại tạo muối và nhiều thành phầm oxy hóa khác nhau như SO2, H2S, S.
3Cr + 4H2SO4 đặc nóng → 3Cr
SO4 + 4H2O + S
- tính năng với phi kim
C + 2H2SO4 sệt nóng → CO2 +2SO2 + 2H2O
S +2H2SO4 quánh nóng → 3SO2 + 2H2O
- tác dụng với những chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
- Tính háo nước
C12H22O11 + H2SO4 sệt nóng → 12C +11H2O
Phương pháp pha chế axit sunfuric
Trong công nghiệp, axit sunfuric được chế tạo từ lưu lại huỳnh, oxi và nước theo cách thức tiếp xúc. Bên cạnh đó có thể cung ứng axit sunfuric từ quặng pirit sắt. Ví dụ quá trình ra mắt như sau:
- Đốt quang đãng pirit fe hoặc lưu hoàng để chế tạo khí SO2
S + O2 → SO2
4Fe
S2 + 11O2 → 2Fe2O3 + 8SO2
SO2 sinh ra có khả năng sẽ bị oxy trở thành lưu huỳnh trioxit bởi ôxi dưới sự có mặt của chất xúc tác oxit vanadi (V2O5)
2SO2 + O2 (xúc tác V2O5, ánh nắng mặt trời 450−500 o
C )→ 2SO3
Sau đó hòa tan lưu huỳnh trioxit bằng nước.
SO3 + H2O → H2SO4
Ngoài ra, SO3 cũng bị hấp thụ vị axit sunfuric và tạo nên thành ôleum (H2SO4.x
SO3).
H2SO4 + x
SO3 → H2SO4.x
SO3
Ôleum sau đó phản ứng cùng với nước để chế tạo axit sunfuric đậm đặc.
H2SO4.x
SO3 + x
H2O → (x+1)H2SO4
Ứng dụng của axit sunfuric trong đời sống
Axit sunfuric tất cả công thức hóa học là H2SO4, là 1 loại axit vô sinh mạnh. địa thế căn cứ vào các đặc thù hóa học, axit sunfuric được áp dụng trong rất nhiều lĩnh vực sản xuất:
- chế tạo giấy, tơ sợi
- Phẩm nhuộm
- Ngành sơn
- Ngành luyện kim
- cấp dưỡng phân bón
- thêm vào hóa chất tẩy rửa
- ...
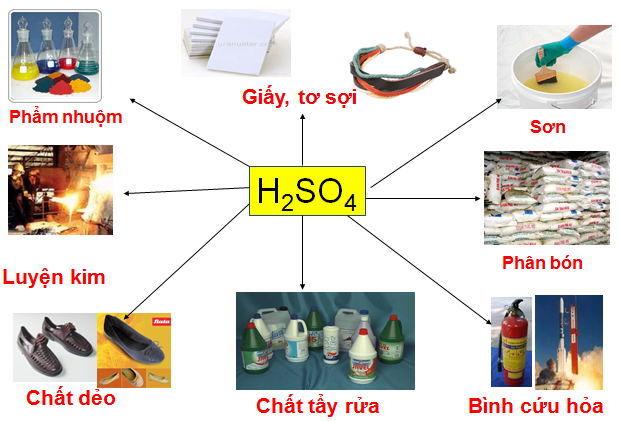
Axit sunfuric được ứng dụng phổ cập trong đời sống làm hóa học tẩy rửa, chất déo, làm giấy,...
Đầu tiên, nó được gọi là một trong loại hóa chất thương mại. H2SO4 được áp dụng để sản xuất ra axit photphoric (H3PO4). Trường đoản cú đó, nó cung cấp nhiên liệu ship hàng quá trình sản xuất phân hóa học, bột giặt, chất tẩy rửa,… Theo những nhà khoa học, bao gồm tới 60% nước nhà trên quả đât sử dụng axit sunfuric như 1 hóa chất không thể thiếu trong những dây chuyền chế tạo này.
Xem thêm: Top 15 Cách Làm Chuông Gió Thủy Tinh, Hướng Dẫn Làm Chuông Gió Bằng Chai Thủy Tinh
Phương pháp được áp dụng là cách thức ướt, sử dụng axit sunfuric để phân hủy vừa lòng chất tất cả trong quặng apatit.
Ca5(PO4)3X + 5H2SO4 + 10H2O → 3H3PO4 + 5Ca
SO4·2H2O + HX
Ngoài ra, đây còn là một thành phần chính để thêm vào nhôm sunfat (công thức chất hóa học Al2(SO4)3), phân phối nylon, dược phẩm, thuốc trừ sâu,…
Axit sunfuric còn tồn tại tác dụng bảo vệ môi trường. Năng lực làm sạch sẽ cống rãnh, hồ hết khu vực ô nhiễm và độc hại đều được thanh lọc sạch bằng những chất tẩy rửa có thành phần đó là axit sunfuric.
Cách pha loãng axit sunfuric quánh đúng kỹ thuật
Như vẫn biết, axit sunfuric bội phản ứng cực dạn dĩ với nước. Nhiệt lượng tỏa ra từ phản ứng này lên tới mức 19KCal. Vị vậy, tín đồ ta hay pha loãng axit sunfuric nhằm sử dụng.
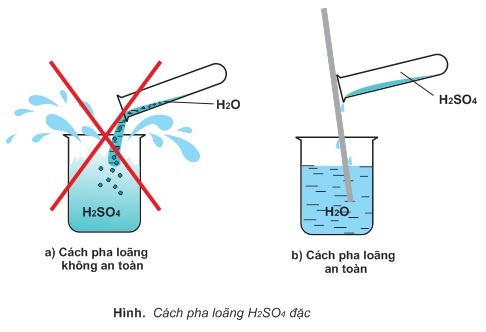
Axit sunfuric gặp gỡ nước
- hình thức pha loãng: muốn pha loãng h2so4 đặc nên Rót axit sunfuric (H2SO4) vào nước chứ không cần làm ngược lại.
- làm việc pha loãng: trộn nước tinh khiết vào cốc thí nghiệm. Mang đến axit sunfuric vào một cốc khác. Phần trăm axit/nước bao nhiêu phụ thuộc vào vào độ loãng của dung dịch. Bạn cần sử dụng một dòng đũa chất thủy tinh để thực hiện quy trình này. Sau đó, đặt loại đũa thủy tinh trong đứng thẳng, rót rảnh rỗi H2SO4 dọc theo thân đũa tính đến khi hết với khuấy nhẹ. Để an toàn nhất, các thao tác làm việc này nên được gia công trong phòng phân tách – nơi có đủ những dụng nạm thí nghiệm đề nghị thiết. Nếu như không bạn cũng có thể thay cầm bằng những vật dụng tương tự.
Những xem xét - chú ý khi pha loãng dung dịch axit sunfuric H2SO4 đặc
Dường như phương pháp pha loãng dung dịch axit sunfuric khá đơn giản và dễ dàng và dễ hiểu. Vậy khi pha loãng cần lưu ý những điều gì?
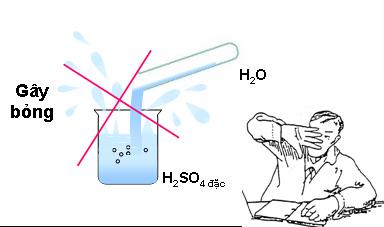
Không được đổ nước vào axit sunfuric đậm đặc
- Đầu tiên, không bao giờ được đổ nước vào axit sunfuric. Bởi nó rất háo nước, giả dụ rót nước vào axit sunfuric sẽ hoàn toàn có thể gây nổ, khiến bạn bị thương: phỏng rộp da, ăn mòn,…
- không nên pha vào những bình thủy tinh bởi vì bình thủy tinh trong dễ biến hóa bởi tác động ảnh hưởng của nhiệt. Đây là phản bội ứng lan nhiệt hết sức mạnh cho nên việc dùng những cốc vật liệu bằng nhựa là giải pháp hợp lý nhất.
- không được nhằm axit sunfuric tiếp xúc với da, đôi mắt và con đường hô hấp. Ví như hít đề nghị axit sunfuric, chúng ta có thể bị ho, tức ngực, khó khăn thở. Axit sunfuric bám dính mắt khiến phồng rộp, rát, đỏ mắt,…Nói chung đây là một axit rất nguy nan với sức mạnh con người. Nếu rủi ro xảy ra, phương pháp duy tuyệt nhất là gửi nạn nhân tới các trạm y tế sớm nhất để được hỗ trợ kịp thời. Kết quả của quy trình pha loãng axit sunfuric không đúng cách đó là lời lưu ý nghiêm trọng nhất so với chúng ta.
Cách bảo quản axit sunfuric
- bảo vệ axit sunfuric trong những bồn, phuy nhựa. Hoàn hảo không áp dụng bồn chứa bởi nhôm, thiếc, inox với kẽm bởi vì axit sunfuric tất cả tính ăn mòn sắt kẽm kim loại rất mạnh.
- Đối với các bồn sắt phệ chứa axit sunfuric đều yêu cầu tráng lớp PU và che nắp kín, đặt vị trí khô ráo, kiêng xa nơi tất cả chưa bazơ hay những chất khử.
- Không nhằm gần những kim loại, sắt kẽm kim loại nhẹ, các chất bao gồm tính axít để tránh gây nổ và cháy như HCl, axit nitric, axit photphoric, ….
Bài viết là 1 số xem xét nhỏ, mong mỏi rằng để giúp đỡ ích cho chính mình trong quá trình pha loãng axit sunfuric. Người tiêu dùng hàng có nhu cầu sử dụng axit sunfuric hãy truy cập cập website https://labvietchem.com.vn/ để coi thông tin chi tiết sản phẩm. Cửa hàng chúng tôi cung ứng con số lớn axit sunfuric đáp ứng các nhu cầu học tập và nghiên cứu hóa, lý sinh.
Sơ lược về axit sunfuric H2SO4
Axit sunfuric H2SO4là một trong những axit vô cơ gồm các nguyên tố giữ huỳnh, oxy cùng hydro với công thức hóa học là H2SO4.

Cấu tạo nên phân tử của axit sunfuric
1. đặc thù vật lý
Là chất lỏng, hơi nhớt, khó cất cánh hơi, nặng rộng nước cùng tan vô hạn trong nướcKhi chức năng với nước tỏa nhiệt độ nhiều
Có thể làm cho than hóa các hợp chất hữu cơ
2. đặc thù hóa học
2.1. Đối cùng với axi sunfuric loãngLà một axit dạn dĩ mang rất đầy đủ các đặc thù hóa học tầm thường của axit
Đổi color quỳ tím: có tác dụng quỳ tím hóa đỏTác dụng với kim loại đứng trước H (trừ Pb) đã cho ra muối sunfat
Fe + H2SO4→ Fe
SO4+ H2
Na2CO3+ H2SO4→ Na
SO4+ H2O + CO2
H2SO4+ 2KHCO3→ K2SO4+ 2H2O + 2CO2
Tác dụng cùng với oxit bazơFe
O + H2SO4→ Fe
SO4+ H2O
H2SO4+ Na
OH→ Na
HSO4+ H2O
H2SO4+ 2Na
OH→ Na2SO4+ H2O
Có tính axit cùng oxi hóa mạnh
Tác dụng với kim loạiCu + 2H2SO4→ Cu
SO4+ SO2+ 2H2O
C + 2H2SO4→CO2+ 2H2O + 2SO2
2P + 5H2SO4→ 2H3PO4+ 5SO2+ 2H2O
Tác dụng với những chất khử khác2Fe
O + 4H2SO4→ Fe2(SO4)3+ SO2+ 4H2O
C12H22O11+ H2SO4→12C + H2SO4.11H2O
3. Điều chế H2SO4
Trong công nghiệp, axit sunfuric được thêm vào từ lưu huỳnh, nước thuộc oxi bằng phương thức tiếp xúc. Quanh đó ra, còn có thể điều chế từ quặng pirit sắt
Đốt quặng pirit fe hoặc lưu lại huỳnh tạo nên khí SO2S + O2→ SO2
Fe
S2+ 11O2→ 2Fe
O3+ 8SO2
C tạo thành lưu huỳnh trioxit
2SO2+ O2→ 8SO3
Hòa rã SO3bằng nước chiếm được H2SO4SO3+ H2O → H2SO4
Ngoài ra, SO3cũng bị hấp thụ vì chưng H2SO4tạo ra oleum với bí quyết H2SO4.xSO3
H2SO4+ x
SO3→ H2SO4.x
SO3
H2SO4.x
SO3+ x
H2O → (x+1)H2SO4
4. Ứng dụng của axit sunfuric
Axit sunfuric được ứng dụng rộng rãi trong nhiều nghành từ cấp dưỡng giấy, tơ sợi, phẩm nhuộm, phân bón, hóa học tẩy rửa, ngành sơn, luyện kim,…Nó được biết đến là một trong những hóa chất thương mại. Tất cả tới 60% sản lượng axit sunfuric trên trái đất được vận dụng trong cung ứng axit photphoric (H3PO4) – một chất thực hiện để sản xuất các loại phân phopahte, amoni photphate,..Ứng dụng trong thêm vào kim loại để gia công sạch mặt phẳng thép cùng tẩy gỉDùng trong chế tạo nhôm sunfat hay các loại muối bột sunfat, tiếp tế nylon, chế tác sinh học cùng dung dịch trừ sâu,…Cùng cùng với nước làm hóa học điện giải trong mặt hàng loạt những dạng ắc quy hay axit chì,…Trong có tác dụng sạch: là thành phần bao gồm của một số trong những chất tẩy rửa làm cho sạch cống rãnh hay các khu vực ô nhiễm
Trong phòng thí nghiệm: giúp rất nhiều chế một số loại axit yếu hơn hoàn toàn như là HNO3, HCl.

Ứng dụng của axit sunfuric
Cách pha loãng axit sunfuric H2SO4 đặc an toàn
1. Lý lẽ pha loãng
Rót axit sunfuric H2SO4vào nước chứ không được làm ngược lại2. Làm việc pha loãng
Cho nước tinh khiết vào trong 1 chiếc cốc thí nghiệmCho axit sunfuric vào một trong những cốc khác
Phụ thuộcvào độ loãng của dung dịch cơ mà có phần trăm axit/nước
Cần một cái đũa thủy tinh để thực hiện quá trình. Đặt chiếc đũa thủy tinh trong đứng thẳng, rót ung dung axit sunfuric dọc từ thân đũa cho tới khi hết rồi khuấy nhẹ
Nên thực hiện quá trình này trong phòng thể nghiệm – địa điểm có không thiếu các dụng cụ cần thiết để bảo đảm an toàn. Ví như không bạn có thể thay thế bởi những trang bị dụng tương tự.

Cách trộn loãng dung dịch H2SO4đặc
Lưu ý bình yên khi pha loãng axit sunfuric đặc
Tuyệt đối ko được đổ nước vào axit sunfuric đậm đặc. Vì H2SO4rất háo nước, nó có tác dụng tan vô hạn vào nước với tỏa không hề ít nhiệt. Khi đổ nước vào trng hỗn hợp H2SO4, nước đã sôi bất ngờ đột ngột và kéo theo những giọt axit bắn ra xung quanh, tạo bỏng, ăn mòn da,…Không bắt buộc pha vào trong các bình thủy tinh do nó dễ đổi khác khi bị ảnh hưởng tác động bởi nhiệt. Trong lúc đó, phản ứng này tỏa không hề ít nhiệt buộc phải cần thực hiện cốc vật liệu bằng nhựa là phương án hợp lý.Không để axit sunfuric xúc tiếp với da, đôi mắt hay mặt đường hô hấp vì hoàn toàn có thể gây gian nguy như ho, nặng nề thở, bỏng rát,… Nếu xảy ra sự cố không muốn cần gửi nạn nhân mang đến trạm y tế gần nhất để được cung ứng kịp thời.Khi trộn loãng axit sunfuric cần bảo đảm theo đúng các nguyên tắc để đảm bảo an toàn.
Lưu ý ko đổ nước vào dung dịch H2SO4khi trộn loãng axit sunfuric đặc









